- 새로운 뉴스를 올려주세요.
| Date | 21/06/10 00:48:28 |
| Name | 하트필드 |
| Subject | 백신 접종 이후 "타이레놀만 달라"…한 달째 품절 |
|
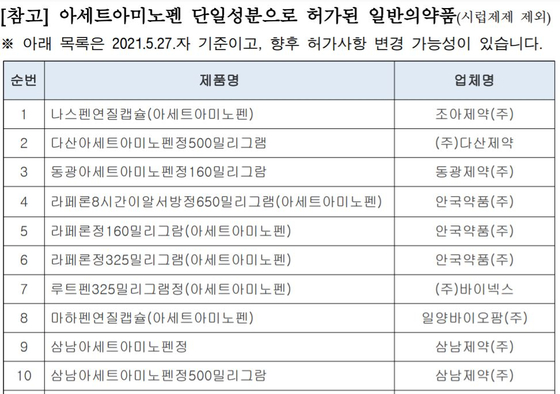
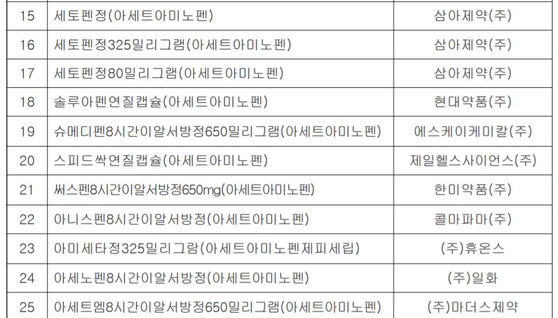
https://news.jtbc.joins.com/article/article.aspx?news_id=NB12011960 [장동석/20년차 약사 : 아세트아미노펜 이 성분의 약만 먹으면 되니까 똑같아요. 용량, 용법도 똑같고 효과, 효능 똑같기 때문에.] [성분이 똑같은 다른 약을 권했다가 실랑이가 벌어지기도 합니다. 서울 B약국 손님 : 왜 우리나라는 없어. 어디 있어 타이레놀이? 이건 타OO이잖아. 짝퉁 타OO이잖아.]] ------ 펨코 보다가 며칠전 탐라가 생각나서. 꼭 타이레놀이 아니어도 된다합니다. https://news.jtbc.joins.com/article/article.aspx?news_id=NB12007955 "타이레놀만 찾지 마세요" 대체 가능한 제품 70개 의약품안전나라(https://nedrug.mfds.go.kr) → 의약품 등 정보 → 의약품 및 화장품 품목정보 → 의약품 등 정보검색 0
이 게시판에 등록된 하트필드님의 최근 게시물
|
|